Equipements


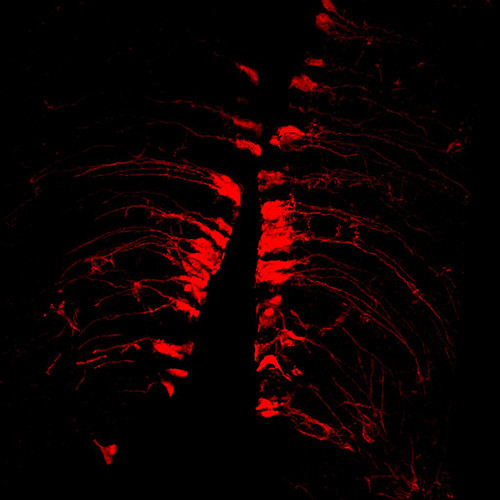
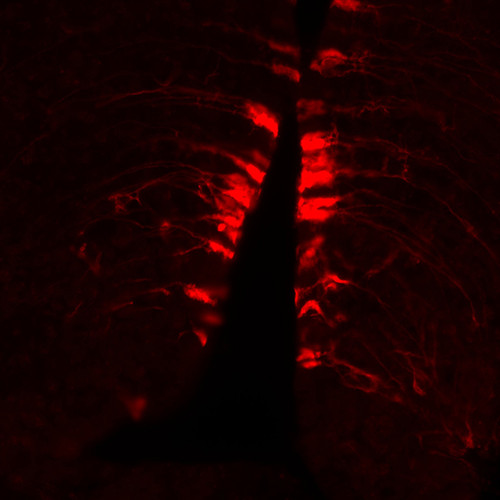
Ce microscope confocal est conçu pour acquérir des images à haute résolution spatiale de cellules ou tissus biologiques par fluorescence. Le principe confocale utilise un sténopé (pinhole) réglable pour éliminer toute la fluorescence ne provenant pas du plan focale. Les lasers fournissent une lumière intense ponctuelle qui est balayée sur la préparation. La fluorescence émise par chaque point est quantifiée et utilisée pour représenter la luminosité de l’objet (image).
Cette méthode offre une grande résolution XY et XZ (gain jusqu’à 15% en XY et 30% en XZ par rapport à un microscope à épifluorescence).
- Statifs inversé DM IRE2
- Lasers : Argon raies à 458, 476, 488, 514 nm (20mW)
Hélium néon raie à 543nm (1,5mW)
Hélium néon raie à 633nm (10mW)
Important : Notre système ne possède pas de raie UV. Pour visualiser les noyaux vous pouvez utiliser du TO PRO3, DRAQ 5 qui utiliseront la raie 633 nm ou de l’iodure de propidium qui utilisera la raie 543nm…
- 3 détecteurs pour la fluorescence couplés à un système de fente spectrale (aucun filtre d’émission)
- 1 détecteur en transmission/DIC
- Platine motorisée en XY pour des acquisitions en multiposition et mosaïque (accepte les lames et les boite de pétri 35mm)
- Motorisation en Z via platine galvanométrique
- Objectifs :HCX PL APO CS 40X 1,25 oil (Rxy 156,2nm Rxz 334,4nm à 488nm) WD 100µm
HCX PL APO CS 63X 1.32 oil (Rxy 147.9nm Rxz 285.8nm à 488nm) WD 70µm
HCX PL APO CS 100X 1.4 oil (Rxy 139,4nm Rxz 235,8nm à 488nm) WD 90µm
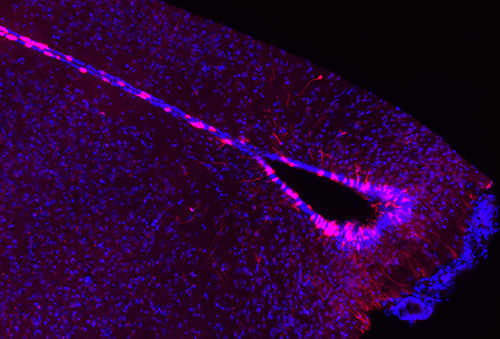
Ce microscope permet d’obtenir une image avec une résolution xz proche de celle obtenue via un microscope confocal conventionnel. Le balayage de l’échantillon se fait par rotation rapide d’une roue constituée de millier de sténopés (pinhole). Lorsque la roue tourne, l’échantillon va être illuminé fois par tour.
De la même façon qu’un microscope confocal conventionnel, seule la fluorescence émise par le plan focal sera collectée par une caméra CCD ou sCMOS. La grande vitesse de rotation de la roue ainsi qu’une excitation à un niveau relativement faible permet des acquisitions très rapides tout en limitant le photoblanchiment et la phototoxicité.
- Statif inversé DMI 4000
- Lasers : Laser UV raie 405nm (50mW)
- Laser Blue raie 488nm (50mW)
- Laser Cobolt Jive raie 561nm (50mW)
- Laser Coherent Cube raie 635nm (25mW)
- Filtres Semrock :
FF01 525/50
FF01 600/37-25
FF01 440/521/607/700
- Tête spinning disk Yokogawa CSU22
- Caméra photometrics EMCCD haute sensibilité QuantEM 512SC
- Tête FRAP équipée de 2 lasers 405nm et 473 nm permettant de réaliser des expériences de photoactivation et de FRAP
- Objectifs :HCX FL PLAN 10X 0,25 dry PH1 WD 5,9mm
HCX FL L 20X 0,4 dry PH1 WD 6,9mm
HCX FL PL FLUOTAR L 40X 0,6 dry PH2 WD 3,3mm
HCX PL APO 63X 1.4 oil PH3
HCX PL APO 100X 1.4 oil
- Platine motorisée en XY pour des acquisitions en multiposition (accepte les lames et les boite de pétri 35mm)
- Contrôle en température assuré par une chambre thermostatée
- CO2 contrôlé au niveau de l’échantillon

Cellules MA104 - Sonde Calcium MC164 - 5 coupes toutes les 10s
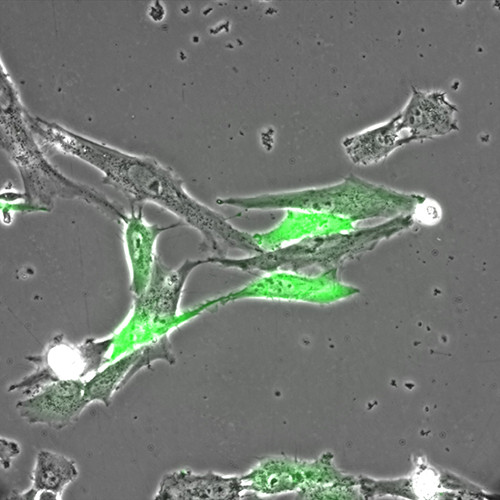
Le microscope plein champ permet l'acquisition d'images et de films par une caméra CCD, d'échantillons vivants ou fixés. Ces échantillons peuvent être de petites tailles (cellules, bactéries, levure...) ou des coupes de tissus.
Les acquisitions peuvent être réalisées dans les 3 dimensions de l'espace (X, Y et Z), au cours du temps, en mode lumière blanche ou fluorescence multicouleurs. Notre microscope est équipé d’une caméra noir et blanc (contrast de phase, DIC, fluo) et d’une caméra couleur (lame histo).
- Statif inversé Olympus IX83
- Caméra noir et blanc: Hamamatsu Flash4. Capteur CMOS 2048x2048 pixels, taille du pixel 6,5µm
- Caméra couleur : Olympus SC50. Capteur CMOS 2560x1920 pixels, taille pixel 2,2µm
- Filtres dichroïques Chroma :
« DAPI » excitation 350/50 émission 460/50
« EGFP » excitation 480/30 émission 535/40
« mCherry » excitation 560/40 émission 635/60
« Cy5 » excitation 620/50 émission 690/50
- Sources lumineuses : Xcite LED ou Xcite 120PC
- Logiciel : Cell sens dimension V1.14 + module Count and mesure + module deconvolution
- Objectifs :
UPLFLN 10X sec 0,30 WD 10mm
LUCPLFLN 20X sec 0,45 WD 6,6 à 7,8 mm bague correctrice
LUCPLFLN 40X sec 0,6 WD 62,7 à 4 mm bague correctrice
UPLSAPO 60XS2 Silicone WD 0,3 mm
- Platine Motorisée en XY : possibilité de multi-position, mosaïque, scann de lame
- Chambre CO2 : Pecon cell vivo
- Chambre thermostatée : Pecon cell vivo
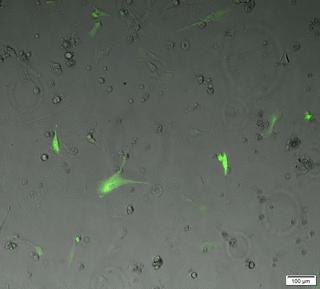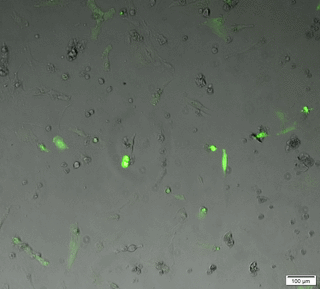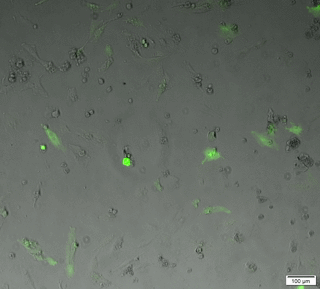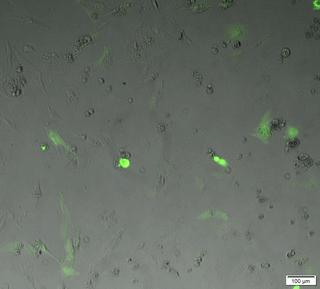
Time laps 24h en contrast de phase+fluo